안전성 정보 관리의 필요성
지속적인 안전성 관리의 중요성
- 임상시험 중에 발생한 이상반응 (AEs)과 중대한 이상반응 (SAEs)에 대해 즉각적인 관리가 가능하다.
(임상시험 대상자의 안전성 측면에서 보호)
- 새로운 약물의 안전성 이슈를 빨리 확인할 수 있게 된다.
- 약물이상반응(Adverse Drug Reactions)을 추적 및 관리하고, 약물의 Risk/Benefit Ratio를 평가하여,
안전성 프로파일을 정의할 수 있다.
- 안전한 약물을 Market에 시판함으로써 공공 보건을 보호한다.
- 최근에는 신약개발 경향이 희귀질환제 개발로 변화되면서 임상시험 참여가 곧 치료기회로
이어지고 있는 추세로, 임상시험 참여에 대한 욕구가 높아짐에 따라 체계적 관리도 필요한 상황이다.
용어의 정의
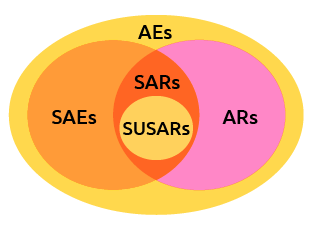
이상반응 (Adverse Event)
- 임상시험용 의약품을 투여한 시험 대상자에게 발생한 모든 유해하고 의도하지 않은 증후, 증상 또는 질병을 말하며, 해당 임상시험용 의약품과 반드시 인과관계를 가져야 하는 것은 아니다.
약물이상반응 (Adverse Drug Reaction)
- 임상시험용 의약품의 임의 용량에서 발생한 모든 유해하고 의도하지 않은 반응으로써
임상시험용 의약품과의 인과관계를 부정할 수 없는 경우를 말한다.
관련성 분류
- Causality Assessment & Management
→ 의뢰자는 의약품 등의 안전에 관한 규칙 별지 제77호 서식 중 약물이상반응과 의심되는 약물과의 관계를 관련성이 있음 또는 관련성이 없음으로 구분하여 보고하기 위해 사전에 관련성에 대한 분류기준 등을
명확히 정하여 관리해야 한다.
- 관련성 분류의 예
→ 관련성이 있음, Certain, Probable, Possible
→ 관련성이 없음, Unlikely, Not Related
- Dual Assessment by 의뢰자 & 연구자
→ 둘 중 하나라도 Related로 평가한 경우 Related로 간주함
→ 의뢰자는 연구자의 평가를 Downgrade 할 수 없음
→ 연구자 평가가 없거나 불확실한 경우 Related로 간주함
|
직관적 인과성 평가 (WHO-UMC System)
|
|||||
|
|
Time
relationship
|
Rechallenge
|
Exclusion
|
Novelty
|
Dechallenge
|
|
약물투여-AE 발생의 시간적 선후관계
|
재투여 시 발생여부
|
약물 이외의 다른 원인유무
|
약물에 대해 이미 알려진 정보여부
|
투여중단 시 AE 소멸여부
|
|
|
Certain
|
Yes
|
Yes
|
Drug↑↑
|
Yes
|
Yes
|
|
Probable
|
Yes
|
No
|
Drug↑
|
No
|
Yes
|
|
Possible
|
Yes
|
No
|
Drug=Others
|
No
|
? (정보없음)
|
|
Unlikely
|
No
|
No
|
Others↑
|
No
|
모호함
|
이상반응과 이상약물반응의 주요한 차이점
시험약과의 인과관계 여부
- 이상반응:
인과관계가 반드시 있어야 하는 것은 아니다.
- 약물이상반응:
인과관계를 부정할 수 없다.
용어의 정의 (SAE)
중대한 이상반응 (Serious Adverse Event):
임상시험용 의약품의 임의 용량에서 발생한 이상반응 또는 이상약물반응 중에서
다음의 어느 하나에 해당하는 경우를 말한다.
1) 사망하거나 생명에 대한 위험이 발생한 경우
2) 입원할 필요가 있거나 입원 기간을 연장할 필요가 있는 경우
3) 영구적이거나 중대한 장애 및 기능 저하를 가져온 경우
4) 태아에게 기형 또는 이상이 발생한 경우
5) 1)부터 4)까지의 사례 외에 약물 의존성이나 남용의 발생 또는 혈액질환 등 그 밖에
의학적으로 중요한 상황이 발생하는 사례
중요한 의학적 사례:
적절한 의학적 판단에 기초하여 해당 사례가 시험대상자를 위태롭게 할 수 있고,
위에서 언급한 중대한(Serious)으로 분류되는 결과들 중 어느 하나로 진행되는 것을 막기 위해
의학적 또는 수술적 개입이 요구될 때 중대한(Serious) 것으로 간주
예시)
- 응급실 또는 가정에서의 집중 치료를 요구하는 알레르기성 기관지경련
- 입원치료를 요구하지 않는 조혈 장애 또는 경련
- 증상이 있는 약물 남용 사례 등
Hospitalization does not need to be reported as an SAE if:
- Treatment for a pre-existing condition, without deterioration and no new AE
- Planned prior to entering the trial (Clearly Documented)
- Diagnostic admission
- Protocol-specified admission
- Administrative admission (e.g., Yearly Physical)
- Respite or social care
- Elective surgery
- Emergency room treatment, not overnight stay
Summary of Adverse Events
- 이상반응의 보고는 대상자가 동의서에 서명한 이후부터 시작되고, 임상시험 계획서에 명시된 추적관찰기관까지 지속된다.
START point:
Informed Consent OR Start of Intervention
- 이상반응의 분류
중대하지 않은 이상반응 (Non-serious Adverse Events (NSAEs))
중대한 이상 반응 (Serious Adverse Events (SAEs))
기타 보고 대상 안전성 관련 사건
임상적 관심 대상 사건: e.g., 약물에 의한 잠재적인 간 손상
과량 투여
암발생
임신 중 약물 노출
수유 중 약물 노출
용어의 정의 (Unexpected ADR)
예상하지 못한 약물이상반응 (Unexpected ADR):
임상시험자 자료집 또는 의약품의 첨부 문서 등 이용가능한 의약품 관련 정보에 비추어 약물이상반응의
양상이나 위해의 정도에서 차이가 나는 것을 말한다.
→ 임상시험으로부터 새롭게 얻거나 또는 다른 출처로부터 보고된 정보가 예상하지 못한(Unexpected)
것인지 아닌지를 결정하는 근거는 임상시험 중인 특정 약물에 대한 임상시험자 자료집에 기재된
이상반응과 의심되는 약물이상반응에 의존한다.
- 임상시험자 자료집에 기재되지 않은 사례는 예상하지 못한(Unexpected)으로 간주
- 임상시험자 자료집에 기재되면 예상되는(Expected)로 간주
- 새로운 이상반응 정보가 입수되면, 임상시험용 의약품의 안전성 보고 목적에서의 예상하지 못한
사례인지를 판단하는 것은 의뢰자의 책임
예상하지 못한(Unexpected)이란?
이상반응 또는 의심되는 약물이상반응이 임상시험자 자료집(IB)에 기재되어 있지 않거나 혹은
관찰된 특이성(Specificity)이나 중증도(Severity)가 기재되어 있지 않는 경우
예시)
1) 임상시험자자료집에 간염과 간효소의 상승만 언급되어 있다면, 간괴사는 그 중증도가 더 크다는 점에서 예상하지 못한(Unexpected)것으로 간주
2) 임상시험자 자료집에 뇌혈관사고만 기재되어 있다면 뇌혈전색전증과 대뇌혈관염은 특이성이
더 높다는 점에서 예상하지 못한(Unexpected)것으로 간주
→ 동일 계열 약물(A Class of Drugs) 투여 시 발생하거나 또는 약물의 약리작용 특성으로부터 예상된다고 임상시험자 자료집에 언급되지만, 임상시험 중인 특정 약물 투여 시 발생한다고 구체적으로 언급되지 않은 이상반응 또는 의심되는 약물이상 반응에 적용.
→ 즉, 동일 계열 약물에서 발생하거나 해당 약물의 약리학적 특성으로부터 예상되는 것으로 임상시험자
자료집에 기재된 이상반응은 임상시험 중인 약물에서 발견하기 전까지는 예상하지 못한(Unexpected)
것으로 간주
- 임상시험 중인 시험약에서 발생된 이상반응에 대해 Expectedness를 확인할 수 있는 문서:
Investigator’s Brochure (IB)
- IB의 개정주기:
일반적으로 1년에 한번 개정
시험자의 역할
KGCP
1. 시험책임자는 임상시험 실시 전에 안전성 정보를 심사위원회에 제출하고 심사위원회의 검토를 받아야
한다.
2. 시험책임자가 심사위원회에 신속히 보고
1) 예상하지 못한 중대한 약물이상반응에 관한 사항
2) 대상자의 안전성이나 임상시험의 실시에 부정적인 영향을 미칠 수 있는 새로운 정보에 관한 사항
의뢰자의 역할
SUSAR 보고 양식
- CIOMS – I form (국제보고양식)
- 보고 기한 관련 기준이 되는 정보
→ 8-12: Seriousness 분류
→ 24c: Date Received by Manufacturer
안전성 정보가 포함된 문서:
Generated by Sponsor
- Investigator Brochure (IB)
- SUSAR Report
- Development Safety Update Report (DSUR)
- Dear Investigator Letter (DIL)
- Periodic Line Listing (LL)
- Summary of Product Characteristics (SmPC) / Package Insert (PI)
이상반응 보고 기준 및 절차
|
SUSAR 관련 시험자와 의뢰자의 보고 책임
|
|||
|
용어
|
시험자 책임
|
의뢰자 책임
|
최종 결정 책임
|
|
중대한
(또는 생명을 위협하는)
|
예
(시험자는 모든 중대한 이상사례를 의뢰자에게 즉시 보고해야만 한다)
|
예
|
시험자와 의뢰자의 의견이 다를 경우, 어느 한 쪽이라도 중대하거나 생명을 위협한다고 평가한 경우에는 중대한 것으로 결정한다
|
|
예상하지 못한
|
아니오
("예상됨"을 평가하는 요건은 없다)
|
예
|
의뢰자는 임상시험자 자료집에 기재된 사례인지 여부; 또는 임상시험자 자료집이 요구되지 않거나 사용 가능하지 않다면, 일반적인 임상시험계획서 또는 그 밖의 최근에 신청된 임상시험계획에 기재된 위험 정보와 일치하지 않는지에 근거하여 "예상하지 못한"의 정의에 부합하는 사례인지 여부를 결정할 책임이 있다
|
|
의심되는 약물이상반응
(약물과의 관련성 평가)
|
예
(시험자는 의뢰자에게 인과관계에 대한 평가를 제공해야 한다)
|
예
|
시험자와 의뢰자의 의견이 다를 경우, 어느 한 쪽이라도 의심되는 약물이상반응이라고 평가한 경우에는 그러한 것으로 결정한다.
|
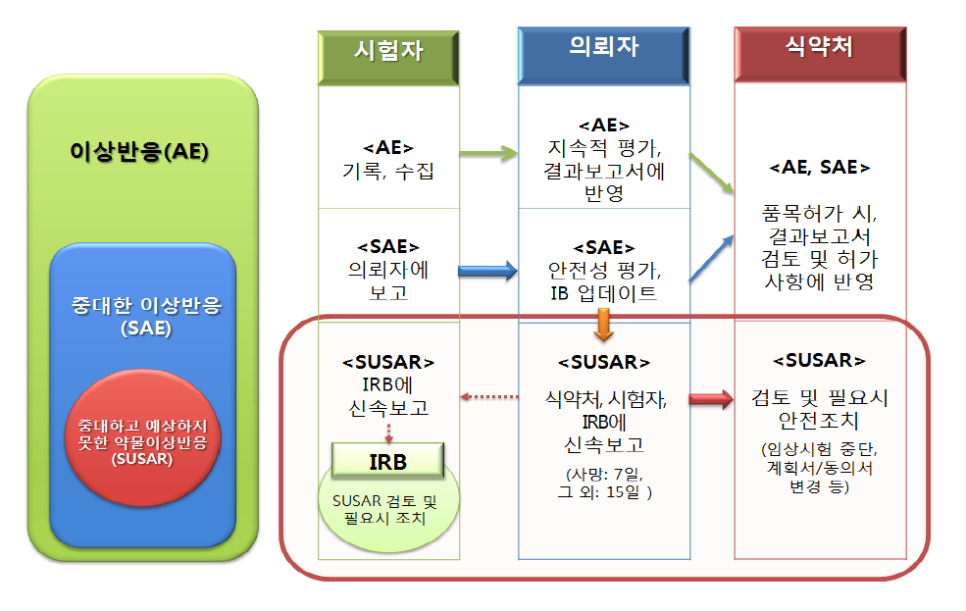
출처: 식약처
Investigator and Sponsor Safety Reporting Timelines
From The Investigator:
1. 중대한 이상반응, 암 발생, 임산
- 초회보고:
Within 24 hours or next day (Whichever comes first)
- 추적보고:
As Soon As Possible or 계획서에 명시된 바 (Once new information is available)
2. 특별 관심 대상 이상반응, 과량투여, 수유 중 약물 노출 포함 그 외의 이상반응 – 계획서에 명시된 바
- All Reporting:
From date event learnt
From The Sponsor:
1. 중대하고 예상하지 못한 모든 약물이상반응 (사망 또는 생명의 위협)
2. 그 밖의 중대하고 예상하지 못한 모든 약물이상반응
3. SUSARs의 추가적인 정보
4. DSUR in 60 days from data lock point
- All reporting: From data received by manufacturer
안전성 정보의 활용
안전성 정보
- DSUR
- PBRER
- RMP
- Label
'임상시험' 카테고리의 다른 글
| [CRA] 임상시험 기초통계 이론 - 연구 설계 (0) | 2023.08.21 |
|---|---|
| [CRA] 임상시험 기초통계 이론 - 기초 통계 개념 (4) | 2023.08.21 |
| [CRA] 임상시험 모니터 요원 신규/초급 - 점검 및 실태조사 ② (0) | 2023.08.17 |
| [CRA] 임상시험 모니터 요원 신규/초급 - 점검 및 실태조사 ① (0) | 2023.08.17 |
| [CRA] 임상시험 모니터 요원 신규/초급 - 임상시험 종료 절차 (0) | 2023.08.17 |